-
診療科目
診療科目ガイド
お勧めコンテンツ
当院の診療科目
消化器内科
内科
禁煙
喫煙と禁煙
たばこを止めよう!
警告
禁煙指導・支援
禁煙の効果
たばこと健康
受動喫煙
たばこの有害物質
糖尿病
高血圧
脂質異常症
脂質異常症とは
高尿酸血症
高尿酸血症とは
肥満・メタボ
肥満とは
骨粗鬆症
睡眠障害
認知症
その他
その他の診療科目
サルコペニア
フレイル
-
診療案内
ご案内
検査・設備
健康管理
予防接種
-
当院について
クリニック紹介
基本理念・行動指針
院長挨拶
院内紹介
院内風景
-
通信
お知らせ
お問い合わせ
お問い合わせ
ひまわり通信
院長の独り言
目次
2013年
2014年
2015年
2016年
2017年
2018年
2019年
2020年
2021年
2022年
2023年
- リンク
- アクセス

スマホ用QRコード
糖質制限ダイエットーその光と影(11)
炭水化物摂取量は多すぎても少なすぎても
総死亡リスクを増加させる
 |
2017年に発表されたPURE研究では炭水化物の摂取量が増えると死亡リスクが上昇するという結果がでました。ただし、この研究では炭水化物摂取比率が40%以下のグループに対する検討は行われていません。それにも関わらず、日本の糖質制限推進論者の中には「40%以下の糖質摂取(制限)により、更なる(直線的に)死亡率が減少する」という、全くもって考えられないような「こじつけ」を行い「詭弁」を弄する輩もいるようです。
2018年に発表された4つのコホート研究(1-2)(ARIC研究)では炭水化物摂取量は多すぎても少なすぎても死亡リスクが上昇するという結果がでました。
ここではARIC研究、それらを加えたメタアナリシス(1)を紹介いたします。
| ARIC研究 |
ARICは30年以上の歴史を持つ米国の重要なコホート研究です。1987年から1989年までの間に米国の4つのコミュニティ(ノースカロライナ州フォーサイス郡、ミシシッピ州ジャクソン、ミネソタ州ミネアポリス郊外、メリーランド州ワシントン郡)で登録された45~64歳の15,428人を対象とした心血管リスク因子(Atherosclerosis Risk)の前向き観察研究(コホート研究)です。Dietary carbohydrate intake and mortality: a prospective cohort study and meta-analysis (日常的食事による炭水化物摂取と死亡率:前向きコホート研究とメタアナリシス)、 Lancet Public Health 2018;3: e419–28
完全な食事情報のない参加者または極端なカロリー摂取のある参加者(男性<600 kcal/日または>4200 kcal/日、女性<500 kcal/日または>3600 kcal/日)は対象から除外されました。1987~1989年に1回目、1990~1992年に2回目、1993~1995年に3回目、1996~1998年に4回目、2011~2013年に5回目、2016~2017年に6回目の調査が行われました。1回目と3回目の調査時に66アイテムのFFQ11-3)を施行し、食事について詳細な問診をおこなっています。主要評価項目は1987~2013年の全死亡です。
炭水化物の摂取エネルギー(11-4)比率から対象者を5群(五分位(11-11))に分け、各分位ごとの死亡リスクが検討されました。最小の炭水化物摂取群(第1五分位、Q1)3086人の全エネルギーに占める炭水化物摂取の中央値(11-6)は37%、最大の炭水化物摂取群(第5五分位、Q5)3085人のそれは61%でした。すべての群の炭水化物摂取の平均11-6)は48.9%でした。炭水化物摂取の少ない群には「年齢が若い、男性、黒人以外の人種、大学卒、BMIが大きい、運動量が少ない、高収入、喫煙者・糖尿病が多い」傾向がありました。
炭水化物摂取最小群(第1五分位、Q1)では、全エネルギーに対し動物性脂質は26.3%、動物性たんぱく質は16.9%と多い摂取量となっていました。一方、植物性たんぱく質は3.9%、食物繊維は13.5gと少ない摂取量となっていました。炭水化物摂取最大群(第5五分位、Q5)では、植物性たんぱく質は4.8%、食物繊維は19.8gと多い摂取量となっていました。
エネルギー摂取量および植物性脂質摂取量は、炭水化物摂取量と逆Uカーブの関係で、最小炭水化物摂取群(Q1)と最大炭水化物摂取群(Q5)は共にカロリー摂取量と植物性脂質摂取量は最低でした。
試験開始後3年目と6年目の体重測定結果から、炭水化物摂取量にかかわらず経過中の有意な体重増加を認めませんでした。
1987~2013年(中央値25年(11-6))までの追跡期間中に6,283人が死亡。交絡因子(11-16)と考えられる、年齢、性別、人種、ARICテストセンター、総カロリー摂取量、糖尿病、喫煙、運動、収入、教育レベルを補正し、炭水化物摂取量と死亡率の関係を求めました。
Restricted cubic splines(制限三次スプライン補間(2)))という解析法を用いて、死亡リスクが最低となる炭水化物摂取比率を求めています。その結果、死亡リスクがもっとも低くなるのは、炭水化物摂取量が全エネルギー比率50-55%の群でした。死亡リスクが最大となったのは炭水化物摂取最小群(Q1)でした(P<0.0001)。炭水化物摂取量と死亡リスクの関係は、非線形(P<0.0001)でU字型の関連性がありました。炭水化物摂取量が全エネルギー比率で65%以上に増加すると、死亡率が高まることが分かりました(図1)。
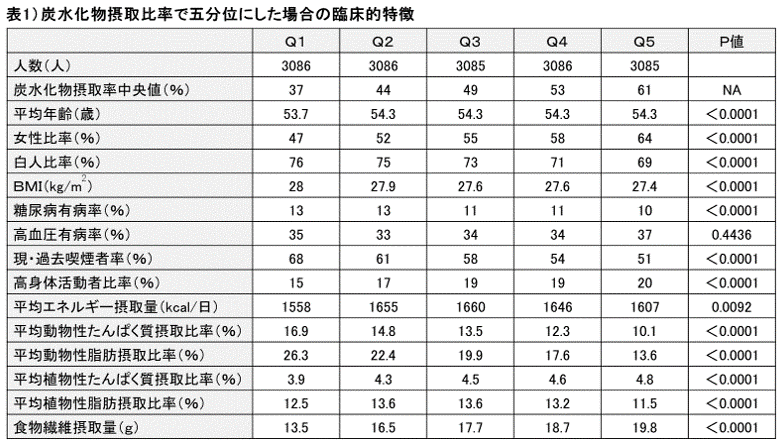 |
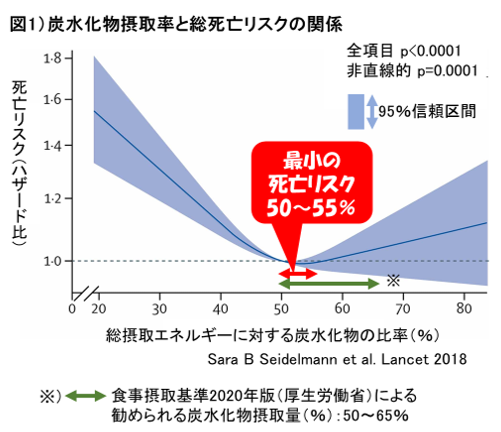
炭水化物摂取率55~55%群の総死亡リスク(HR、Hazard Ratio11-16)を1とすると、40~50%群ではHR1.12(95%CI1-14):1.05-1.21、P<0.000111-15))、30~40%群ではHR1.32(95%CI:1.21-1.43、P<0.0001)、30%未満群ではHR1.58(95%CI:1.34-1.87、p<0.0001)と大きくリスクは増加しています。
一方、炭水化物摂取率55~65%群ではHR1.01(95%CI:0.93-1.10)、65%超群ではHR1.15(95%CI:1.01-1.31、p<0.0001)と、炭水化物摂取が少ない場合と比べてもリスク上昇は軽度でした(図1)。
 |
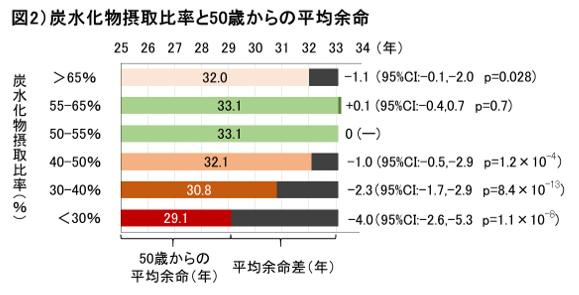
50歳以降の生命予後(3)の試算からは、炭水化物摂取率50~55%の人の場合、平均余命(4)は33.1年と推定されました。これを基準とすると、炭水化物摂取量40~50%の場合は1.0年短く32.1年(95%CI:-0.5,-1.5、p=0.00012)、30~40%の場合は2.3年短く30.8年(95%CI:-1.7,-2.9、p=0.00000000000083)、30%未満の場合は4.0年短く29.1年(95%CI:-2.6,-5.3、p=0.000000011)と推定されました。炭水化物摂取量が減少するに従い生命予後が悪くなることが示されました。逆に、炭水化物摂取量が増加し65%超となった場合の平均余命は1.1年短くなり32.0年(95%CI:-0.1,-2.0、P=0.028)、55~65%の場合は0.1年伸び33.2歳(95%CI:-0.4,0.7、p=0.7→統計的有意差なし)と推定されました。
言い換えると、炭水化物摂取量は全エネルギーの50~65%の範囲内であれば総死亡リスクへの影響は認められず、生命予後の観点からも望ましいという可能性が示唆されました(図2)。
 |
2017年に発表されたPURE研究では、対象の多くが中所得や低所得の国や地域で、ARICの対象の米国は含まれていません。そのPURE研究では、炭水化物摂取比率は平均61%と高くなっていました。
一方、米国のARIC研究では平均49%とPURE研究より低くなっていました。貧富の差を無視すると、PURE研究はARIC研究のうち炭水化物摂取比率の多い群と同じ臨床的特徴を有しているかもしれません。実際、両者は共に非直線的でU字型関連を示しています。そして、PURE研究での高炭水化物摂取群での死亡率との関連はARIC研究で観察された95%信頼区間内11-14)にほぼ収まりました(図3)。
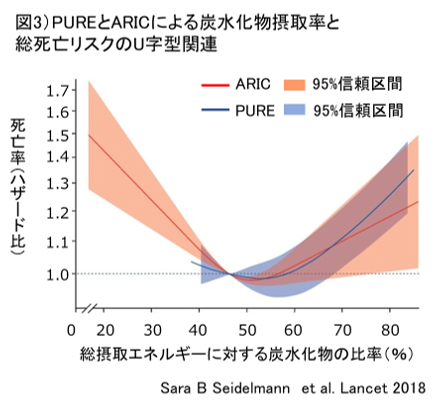 |
炭水化物摂取量(比率)以外に死亡リスクに関与する因子、例えば栄養素や栄養源因子はあるのでしょうか?それについては、炭水化物に取って替わるたんぱく質と脂肪が動物性(動物ベース)なのか、あるいは植物性(植物ベース)なのかについて調査されています。炭水化物の替わりに動物ベースのたんぱく質や脂肪の摂取量が増えると死亡リスクが上昇し(HR:1.20、95%CI:1.09-1.32、p:記載なし)、植物ベースのたんぱく質や脂肪が増えると死亡リスクがあり減少する(HR:0.86、95%CI:0.75-0.99、p:記載なし)ことが示されました。これらのデータは食事中の炭水化物に替わるたんぱく質と脂肪の供給源が、炭水化物摂取と死亡率を著しく修飾する可能性があることを示唆しています。
動物ベースの低炭水化物食では牛肉、豚肉、子羊、皮の付いた鶏肉、皮を剥いだ鶏肉、チーズなどが、植物ベースのそれではナッツ、ピーナッツバター、ダークパン、チョコレート、白パンなどが多く摂られていました。
| 執筆者のコメント:この研究の限界 |
① この研究は観察研究であり臨床介入研究(6)ではない。炭水化物摂取量や他の因子を無作為に分け死亡リスク観察する無作為割り付け臨床介入研究(6)がエビデンスの最も高い臨床介入研究である。しかし、この様な研究は長期間必要であり食事・栄養に関しては非現実的(事実上不可能)(7)である。
② 25年に及ぶ調査のため途中で食事内容が変化している可能性があるが、食事に関する調査が1回目(1987~1989年)と3回目(1993~1995年)にしか行われていない。
| 糖質制限推進論者の反論 |
わが国を代表する2人の糖質制限推進論者の反論を見てみましょう。
① 極端な糖質制限論者である京都・高尾病院理事長、江部孝二氏は、PURE研究では考えられないような「こじつけ」を行い、詭弁を弄していました。しかし、この研究に対しては反論する根拠(この研究を否定できる研究)を見つけることができなかったのでしょうか? 「だんまり」を決めこんでいます。ネット上で調べた範囲内ではありますが、今のところ何の反論も見つけることはできませんでした。
② 緩い糖質制限論者の北里大学の糖尿病センター長・山田悟氏は、流石に「まずい」と思ったのでしょうか? 次の様な反論をしています。ARICはコホート研究(観察研究)であるためそのまま信じることはできない。それを証明するためには無作為割り付け介入研究が必要であると。長期にわたる栄養・食事に関する無作為割り付け介入研究は現実的に不可能7)だと知っているのに! まるで駄々こねる子供のようです。
| ARIC研究で言えること |
- 炭水化物摂取量は多すぎても少なすぎても死亡リスクを高める。
- 最も死亡リスクが低かった炭水化物摂取量は全エネルギー比率50~55%であった
- 炭水化物摂取量が65%超、40%未満から死亡リスクは上昇する。
- 死亡リスク上昇の程度は低炭水化物摂取群の方が高摂取群でより著明であった。
- 炭水化物摂取比率と50歳からの推定される平均余命は、炭水化物摂取比率が50
- 55%で33.1歳。50~55%を基準とすると、65%超で1.1年短く32.0年、30%未満で4.0年短く29.1年となった。
- 炭水化物に替わるたんぱく質と脂肪の供給源が、炭水化物摂取と死亡率を著しく修飾する可能性がある。
- 動物ベースのたんぱく質や脂肪が増える低炭水化物摂取群では死亡リスクが上昇
- 植物ベースのたんぱく質や脂肪が増えると死亡リスクが減少。
- 厚生労働省が勧める日本人の食事摂取基準2020年版での「炭水化物摂取量50~65%」は妥当と考えられる。
註解
1)タアナリシス(Meta-analysis):特定のテーマに関して過去に独立して行われた複数の研究結果を統合して分析する統計解析方法。採用する研究(データ)は信頼できるものに絞り、それぞれに重み付けを行う。メタ解析、メタ分析とも言う。研究を統合することでサンプルサイズが増え推定の精度が上がるため、EBMのための強力な情報源となる。
2) restricted cubic splines(制限三次スプライン補間):スプライン(spline)とは製図などに用いられる一種の自在定規で、しなやかで弾力のある細長い板。平面上の通過すべき点でたわみを支えると、それらを結ぶ滑らかな曲線が得られる。これは弾性エネルギーを最小にする曲線で、数学的には三次スプライン曲線となる。出典: フリー百科事典『ウィキペディア(Wikipedia)より、一部改変補間:数値表や観測で得られた値に基づいて、その間にある表が載せない、または観測していない数値に対する値を算出すること。補間する関数が3次(cubic)関数を使うため3次スプライン補間と呼ばれる。
 |
3) 生命予後:病気・手術などの経過において、生命が維持できるかどうかについての予測。これに対し、疾患部位の機能が維持できるかどうかの予測は機能予後と言う。
4) 平均余命:ある年齢の人が、その後何年生きられるかという期待値のこと。平均寿命とは0歳の時点での平均余命のこと。
5) リスク比(ハザード比)の95%信頼区間が1を跨ぐ:ハザード比とは「1」が基準となり、「1」より大きい場合はリスクが高くなり、「1」より小さい場合はリスクが小さくなることを表している。ハザード比が「1」を超えている場合、例えばHR:1.25は、「死亡や病状進行のリスクが対照群に比べて25%高くなる」。逆に、ハザード比が「1」を超えていない場合、例えばHR:0.77は、「死亡や病状進行のリスクが対照群に比べて23%低くなる」ということを意味する。
ここでハザード比の95%信頼区間を追加してみると次の様になる,
- ハザード比:0.77、95%CI:0.65-0.89
95%信頼区間が1未満(1を跨がない)→統計学的有意差あり
- ハザード比:0.91、95%CI:0.60-1.22
95%信頼区間が1を跨ぐ→統計学的有意差なし
- ハザード比:1.25、95%CI:1.05-1.45
95%信頼区間が1以上(1を跨がない)→統計学的有意差あり
本文の図1)の炭水化物摂取率が低い群(図の左半分)の死亡リスク(ハザード比)の95%信頼区間は1以上で「統計学的有意差あり」となる。しかし、炭水化物摂取率が高い群(図の右半分)のそれは1を跨いでおり「統計学的有意差なし」となる。
6) 臨床介入研究:臨床研究は大別すると観察研究(Observational Study)と介入研究(Intervention Study)がある。観察研究は研究者の積極的な介入を伴わず、対象者の日常的な行動を調査する研究。これに対し介入研究は研究者が対象集団を2つ以上のグループに分け、それぞれ異なる治療法や予防法等に関して、介入を行う研究。医薬品あるいは医療機器の製造承認を得るための「治験」は介入研究の1つ。
7) 食事・栄養に関しての無作為割り付け介入研究は難しい:痩せたい人や低糖質ダイエットに関心がある人を低炭水化物食群、痩せる気のない人や低炭水化物食に関心のない人を対照群(高炭水化物食群)に割り付けたらどうなるか? 前者は指示を守り、しかも総摂取カロリーまで減らすかもしれない。さらに、この機会にと運動を始めるかも…。この問題を防ぐには、研究(試験)の対象となる人の好みにかかわらず無作為に複数の群に分ける方法がある。これを「無作為割り付け」という。
しかし、好みの(希望する)群にならなかった人はやる気を失い、いい加減な食事をするかもしれない。こうなると食事の差を見るのではなく、単に「やる気の差」を見ているだけかも…。低糖質ダイエットに関心がある人を低糖質群と普通食に分けると、この様な問題が起こる。この問題を回避する方法が盲検化(ブラインド化、マスキング)といい、どちらのグループに入っているかを研究参加者(対象者)に知らせず(分からない様に)行うことである。新薬の開発(治験)では新薬(実薬)とプラセボ(偽薬)を作り、患者にだけ分からないようにする単盲検、患者だけでなく医師にも分からないようにする二重盲検が行われる。食事や栄養の世界で「炭水化物量が違うが見た目や味が同じもの」を作るのは至難の業である。すなわち、二重盲検はおろか単盲検も現実的には不可能と言える。
ならば、盲検化は諦めて低炭水化物食、普通食、高炭水化物食の無作為割り付け研究は可能であろうか? 1・2週間から1か月位までなら自分の好み(普段食べている)ではない食事を受け入れてくれる人はいるかもしれない。しかし、何年にも渡り試験食を食べ続けてくれる人はいないであろう。
例えば、院長の独り言 59号 令和元年9月号で取り上げたDIRECT試験。これは低脂肪食と地中海食、低炭水化物食と3群に無作為に分け、食事に関する介入を行い、減量効果や代謝因子への影響をみた試験である。試験開始12か月後の摂取エネルギーを見ると、摂取エネルギー制限はなかったはずの低炭水化物食群で最大の減少となっていた。「無作為割り付け」と言っても被験者(対象者)は自分がどの群に割り付けられたかは一目瞭然である。これでは低炭水化物食の効果を見ているのか、摂取エネルギー制限の効果を見ているのか分からない。また、24か月後では体重リバウンドは低炭水化物食群が最大であった。地中海に面するイスラエルでは地中海食は比較的受け入れやすい食事だが、低炭水化物食への「なじみ」は少なく持続は困難であったと考えられる。このように、食事・栄養に関する無作為割り付け介入研究は極めて困難だと言えよう。

